REACCIONES Y ECUACIONES QUÍMICAS
INTRODUCCIÓN
Los químicos han utilizado un lenguaje químico estándar para representar los cambios que ocurren en una reacción. Por ello es necesario observar con mucho cuidado a las sustancias en sus estados iniciales y finales, esto es, ver y conocer las moléculas de las sustancias que actúan como reactivos y como productos durante el proceso de cambio.


REACCIONES QUÍMICAS
Una reacción química, también llamada cambio químico o fenómeno químico, se produce cuando las sustancias participantes en ella se transforman en otras distintas. A las primeras se les llama reactivos y a las segundas productos, los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un re ordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces. Por ejemplo si ponemos en contacto gas oxígeno y gas hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay inicialmente y que van a "desaparecer" decimos que son las sustancias que reaccionan o los reactivos y el agua que es la nueva sustancia, la que "aparece", decimos que es el producto.
Para que algunas sustancias se transformen en otra u otras, sus átomos deben separarse, unirse o reorganizarse, y para ello es necesario que se formen o se rompan enlaces químicos, que son las fuerzas que mantienen unidos a los átomos.
Los químicos han utilizado un lenguaje químico estándar para representar los cambios que ocurren en una reacción. Por ello es necesario observar con mucho cuidado a las sustancias en sus estados iniciales y finales, esto es, ver y conocer las moléculas de las sustancias que actúan como reactivos y como productos durante el proceso de cambio.
OBJETIVOS
- Reconocer las partes de una reacción química.
- Saber los pasos necesarios para elaborar una ecuación química.
- Conocer y analizar las diferentes reacciones químicas.

Una reacción química, también llamada cambio químico o fenómeno químico, se produce cuando las sustancias participantes en ella se transforman en otras distintas. A las primeras se les llama reactivos y a las segundas productos, los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva. Esto sucede porque sólo se lleva a cabo un re ordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces. Por ejemplo si ponemos en contacto gas oxígeno y gas hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay inicialmente y que van a "desaparecer" decimos que son las sustancias que reaccionan o los reactivos y el agua que es la nueva sustancia, la que "aparece", decimos que es el producto.
Para que algunas sustancias se transformen en otra u otras, sus átomos deben separarse, unirse o reorganizarse, y para ello es necesario que se formen o se rompan enlaces químicos, que son las fuerzas que mantienen unidos a los átomos.
Dos átomos se separan cuando se aplica sobre ellos una fuerza mayor a la que los mantiene unido. Un átomo se une o enlaza con otro si al hacerlo se libera energía y por lo tanto los dos átomos unidos son más estables que cada uno por separado.
En consecuencia, durante las reacciones químicas los átomos o moléculas participantes pierden (liberan) o ganan (absorben) energía.
CARACTERÍSTICAS DE LAS REACCIONES QUÍMICAS
- La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
- Durante la reacción se desprende o se absorbe energía:
- Reacción exotérmica: se desprende energía en el curso de la reacción.
- Reacción endotérmica: se absorbe energía durante el curso de la reacción.
- Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta.

VELOCIDAD DE UNA REACCIÓN QUÍMICA
Para saber si una reacción es rápida o lenta, hay que conocer la velocidad a la que transcurre. Podemos definir velocidad de reacción como la variación de cantidad de sustancia formada o transformada por unidad de tiempo.
En general, para determinar la velocidad de una reacción, hay que medir la cantidad de reactivo que desaparece o la cantidad de producto que se forma por unidad de tiempo.
Factores que afectan a la velocidad de reacción
La velocidad de una reacción se ve influida por una serie de factores; entre ellos se pueden destacar:
Naturaleza de los reactivos
Se ha observado que según los reactivos que intervengan, las reacciones tienen distinta velocidad, pero no se ha podido establecer aún unas reglas generales.
Concentración de los reactivos
La velocidad de reacción aumenta con la concentración de los reactivos. Para aumentar la concentración de un reactivo:
- Si es un gas, se consigue elevando su presión.
- Si se encuentra en disolución, se consigue cambiando la relación entre el soluto y el disolvente.
Superficie de contacto de los reactivos
Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma.
Temperatura
En general, la velocidad de una reacción química aumenta conforme se eleva la temperatura.
Presencia de catalizadores
Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.

LOS CAMBIOS EN LA MATERIA
La materia puede sufrir cambios mediante diversos procesos. No obstante, todos esos cambios se pueden agrupar en dos tipos: cambios físicos y cambios químicos.
CAMBIOS FÍSICOS
En estos cambios no se producen modificaciones en la naturaleza de las sustancia o sustancias que intervienen. Ejemplos de este tipo de cambios son:
- Cambios de estado.
- Mezclas.
- Disoluciones.
- Separación de sustancias en mezclas o disoluciones.

CAMBIOS QUÍMICOS
En este caso, los cambios si alteran la naturaleza de las sustancias: desaparecen unas y aparecen otras con propiedades muy distintas. No es posible volver atrás por un procedimiento físico (como calentamiento o enfriamiento, filtrado, evaporación, etc.)
Una reacción química es un proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos.
En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen. Entonces, los átomos se reorganizan de otro modo, formando nuevos enlaces y dando lugar a una o más sustancias diferentes a las iniciales.

CLASIFICACIÓN DE LAS REACCIONES QUÍMICAS

1. Por la forma como se originan los productos
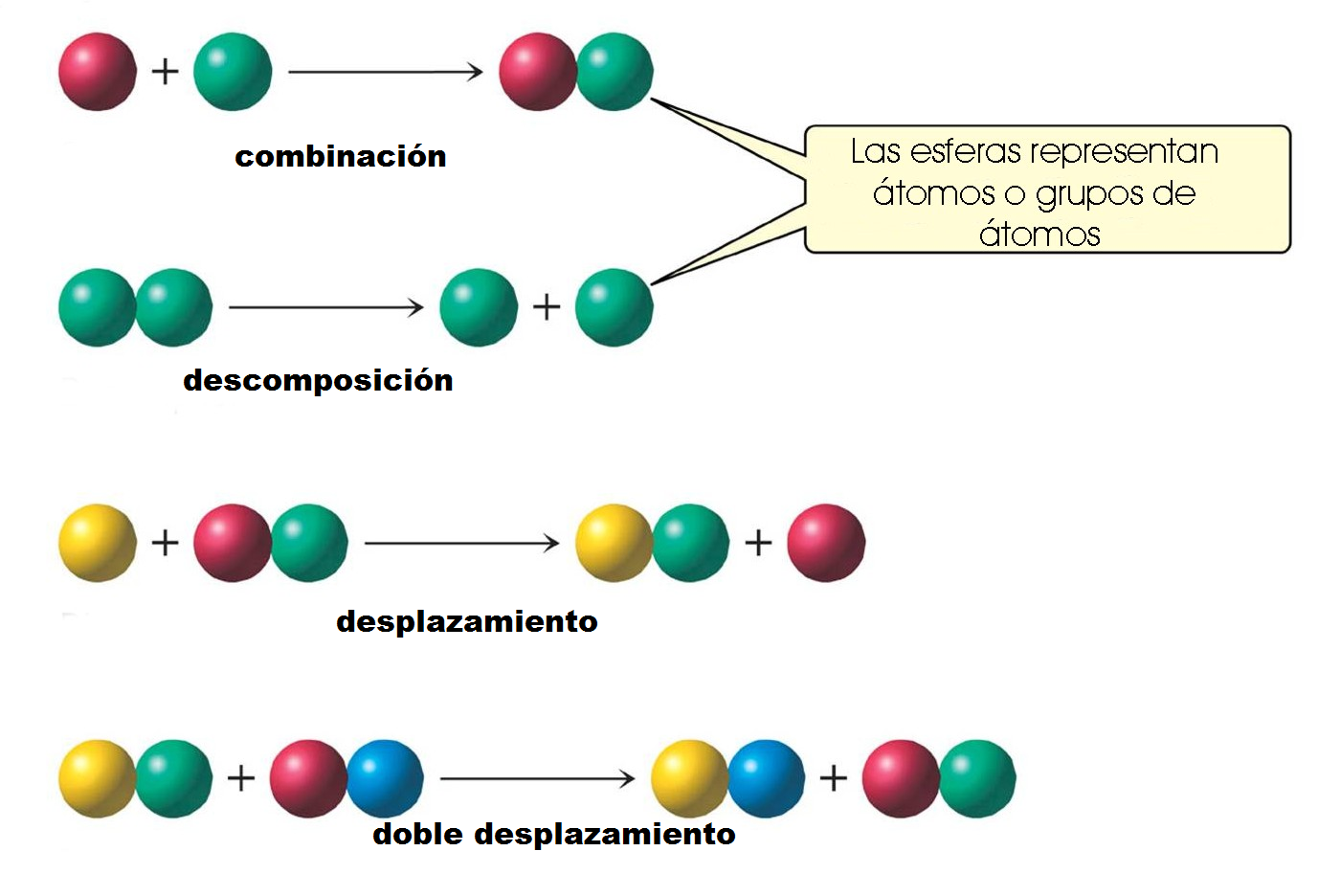
- Reacción de síntesis: Una reacción de síntesis o reacción de combinación es un proceso elemental en el que dos o más sustancias químicas reaccionan para generar un solo producto. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo. La siguiente es la forma general que presentan este tipo de compuestos: A+B→C Donde A y B representan cualquier sustancia química y C el compuesto resultante.Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxi-ácido.Ejemplo: Na2O(s) + H2O(l) → 2Na(OH)(ac) Otras reacciones de síntesis se dan al combinar un no metal con hidrógeno, para obtener un hidrácido. Ejemplo: Cl2(g)+ H2(g) → 2HCl(g) La oxidación de un metal, también es una reacción de síntesis o de combinación. Ejemplo: 4Na(s) + O2(g) → 2Na2O(s)
- Reacción de descomposición: Proceso químico en el que un reactivo forma dos o más productos. Ejemplo: (NH4)2Cr2O7(s) → Cr2O3(s) + N2(g) + 4H2O(l)
- Reacción de desplazamiento o sustitución simple: Proceso químico en el que un elemento químico más activo desplaza a otro elemento menos activo que se encuentra formando parte de un compuesto. Ejemplo: 2Na(s) + 2H2O(l) → 2NaOH(ac) + H2(g)
- Reacción de doble desplazamiento: Proceso químico en el que dos elementos que se encuentran en compuestos diferentes intercambian posiciones, formando dos nuevos compuestos. Ejemplo: Pb(NO3)2(ac) + 2KI(ac) → 2KNO3(ac) + PbI2(s)
2. Reacciones según la energía calorífica involucrada
- Reacción exotérmica: Proceso químico que libera energía calorífica hacia el medio que lo rodea. Ejemplo: N2(g) + 3H2(g) → 2NH3(g) + Energía ; ΔH < 0
- Reacción endotérmica: Proceso químico que absorbe energía del medio que lo rodea. Ejemplo: 3O2 + Energía → 2O3 ; ΔH > 0
3. Reacciones según el sentido de la reacción
- Reacciones irreversibles: Proceso químico que ocurre en un solo sentido. Ejemplo: NaCl(ac) + AgNO3(ac) → AgCl(s) + NaNO3(g)
- Reacciones reversibles: Proceso químico que ocurre en ambos sentidos.Ejemplo: H2(g) + I2(s) ⇆ 2HI(g)
4. Reacciones según la rapidez de reacción
- Reacción lenta: Proceso químico en donde la cantidad de producto formado o la cantidad de reactante consumido por unidad de tiempo es muy pequeña. Ejemplo: 4Fe(s) +3O2(g) → 2Fe2O3(s)
- Reacción rápida: Proceso químico en donde la cantidad de producto formado o la cantidad de reactante consumido por unidad de tiempo es muy grande. Ejemplo: HCl(ac) + NaOH(ac) → NaCl(ac) + H2O(l)
5. Reacciones según el tipo de comportamiento de compuesto o naturaleza de los
reactivos
- Reacciones iónicas: Proceso químico que generalmente ocurre en disolución acuosa; consiste en la interacción eléctrica de especies iónicas solvatadas o dispersas en el disolvente (comúnmente H2O). Ejemplo: Ag+ (ac) + Cl(ac) → AgCl(s)
- Reacciones moleculares o covalentes: Proceso químico que involucra a las interacciones de moléculas (de sustancias covalentes). Ejemplo: 2H2(g) + O2(g) → 2H2O(g)
ECUACIONES QUÍMICAS
Es una forma resumida de expresar, mediante símbolos y fórmulas, una reacción química. En ella determinamos las sustancias reaccionantes, se predicen los productos y se indican las proporciones de las sustancias que participan en la reacción.


Para identificar si ha ocurrido una reacción química es necesario verificar si se ha dado alguno de los siguientes eventos:
- Se produce una efervescencia (produccion de gases).
- Se libera o absorbe energia (cambia la temperatura del matraz o recipiente donde ocurre la reaccion.
- Cambio de color de los reactivos participantes.
- Aparece un precipitado o sustancia insoluble.
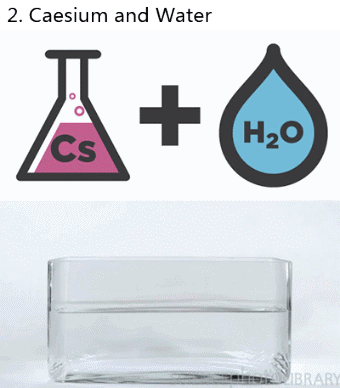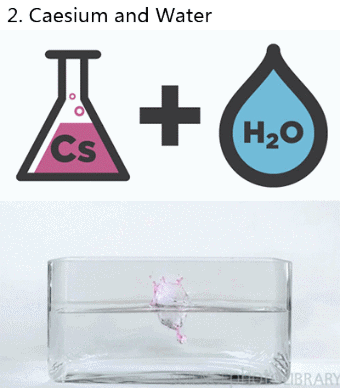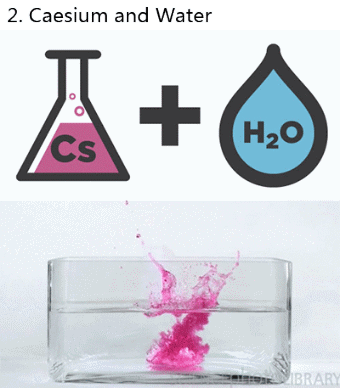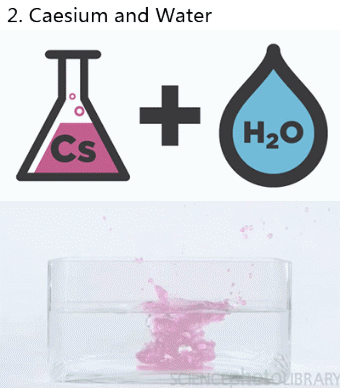
Si se quiere o necesita indicar el estado en que se encuentran las sustancias que intervienen o si se encuentran en disolución, se puede hacer añadiendo los siguientes símbolos detrás de la fórmula química correspondiente:
- (s) = sólido.
- (metal) = elemento metálico.
- (l) = líquido.
- (g) = gas.
- (aq) = disolución acuosa (en agua).
En la siguiente tabla podremos observar los símbolos mas utilizados en las ecuaciones químicas.

Para escribir una ecuación química se tiene que tomar en cuenta que:
1. Debemos saber cómo reaccionan las sustancias y qué nuevos productos se forman.
2. Toda ecuación química debe estar balanceada, es decir que debe de existir la misma cantidad de átomos de un mismo elemento de ambos lados de la ecuación química, por ejemplo, esta es una representación de una molécula de agua oxigenada o peróxido de hidrógeno (H2O2).


Para escribir una ecuación química se tiene que tomar en cuenta que:
1. Debemos saber cómo reaccionan las sustancias y qué nuevos productos se forman.
2. Toda ecuación química debe estar balanceada, es decir que debe de existir la misma cantidad de átomos de un mismo elemento de ambos lados de la ecuación química, por ejemplo, esta es una representación de una molécula de agua oxigenada o peróxido de hidrógeno (H2O2).

PASOS PARA ESCRIBIR UNA ECUACIÓN QUÍMICA
Una ecuación química usa los símbolos y fórmulas de los reactivos y productos, y otros términos simbólicos para representar una reacción química. Las ecuaciones se escriben siguiendo los siguientes pasos:
1. Los reactivos se separan de los productos con una flecha (  ) que indica el sentido de la reacción. Una flecha doble (
) que indica el sentido de la reacción. Una flecha doble (  ) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
2. Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
3. Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula ( ) colocada sobre la flecha (
) colocada sobre la flecha ( ) indica que se suministra calor a la reacción.
) indica que se suministra calor a la reacción.
4. Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
5. El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
6. Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
7. Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
8. Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
9. Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
10. Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
Ejemplo:
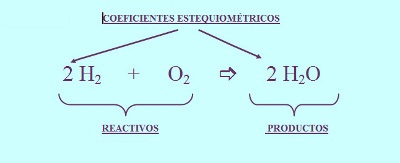
FALTO MAS CONSULTA PARA EL MARCO TEÓRICO DE BALANCEO 4.5
ResponderEliminar