LABORATORIO HIDROCARBUROS AROMÁTICOS
INTRODUCCIÓN
El presente laboratorio tiene como objetivo principal identificar que un hidrocarburo aromático o areno es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π. Para determinar esta característica se aplica la regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en consideración de la topología de superposición de orbitales de los estados de transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
OBJETIVOS
- Reconocer los diferentes derivados sustituidos con nombre propio
- Familiarizarnos con la estructura química del benceno.
- Distinguir las propiedades físicas y químicas de los hidrocarburos aromáticos.
- Reconocer cuando uno de los grupos le da el nombre común.
- Identificar los orientadores a los que le pertenece cada grupo.

MARCO TEÓRICO
HIDROCARBUROS AROMÁTICOS
Los hidrocarburos aromáticos son aquellos hidrocarburos que poseen las propiedades especiales asociadas con el núcleo o anillo del benceno, en el cual hay seis grupos de carbono-hidrógeno unidos a cada uno de los vértices de un hexágono. Los enlaces que unen estos seis grupos al anillo presentan características intermedias, respecto a su comportamiento, entre los enlaces simples y los dobles. Así, aunque el benceno puede reaccionar para formar productos de adición, como el ciclohexano, la reacción característica del benceno no es una reacción de adición, sino de sustitución, en la cual el hidrógeno es reemplazado por otro sustituto, ya sea un elemento univalente o un grupo. Los hidrocarburos aromáticos y sus derivados son compuestos cuyas moléculas están formadas por una o más estructuras de anillo estables del tipo antes descrito y pueden considerarse derivados del benceno de acuerdo con tres procesos básicos:
1. por sustitución de los átomos de hidrógeno por radicales de hidrocarburos alifáticos,
2. por la unión de dos o más anillos de benceno, ya sea directamente o mediante cadenas alifáticas u otros radicales intermedios,
3. por condensación de los anillos de benceno.
Cada una de las estructuras anulares puede constituir la base de series homólogas de hidrocarburos, en las que una sucesión de grupos alquilo, saturados o no saturados, sustituye a uno o más átomos de hidrógeno de los grupos de carbono-hidrógeno. Las principales fuentes de hidrocarburos aromáticos son la destilación de la hulla y una serie de procesos petroquímicos, en particular la destilación catalítica, la destilación del petróleo crudo y la alquilación de hidrocarburos aromáticos de las series más bajas. Los aceites esenciales, que contienen terpenos y p-cimeno, también pueden obtenerse de los pinos, los eucaliptos y las plantas aromáticas y son un subproducto de las industrias papeleras que utilizan pulpa de pino. Los hidrocarburos policíclicos se encuentran en las atmósferas urbanas.
ESTRUCTURA DEL BENCENO
Aunque el benceno se conoce desde 1825, y sus propiedades físicas y químicas son mejor conocidas que la de cualquier otro compuesto orgánico, su estructura no pudo ser determinada de forma satisfactoria hasta 1931. El principal problema era debido no a la complejidad de la molécula en sí, sino que era consecuencia del limitado desarrollo de la teoría estructural alcanzado en aquella época.
Como ya señalamos se conocía su fórmula molecular (C6H6), pero el problema estaba en conocer como se disponían los átomos en la estructura. En 1858 Kekulé propuso que los átomos de carbono se podían unir entre sí para formar cadenas. Posteriormente en 1865 propuso para poder resolver el problema del benceno, que estas cadenas carbonadas a veces se pueden cerrar formando anillos. Para representar la estructura del benceno se habían propuesto las siguientes:
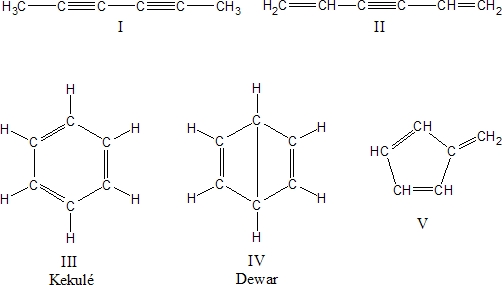
Todos estos intentos de representar la estructura del benceno representaban las distintas formas en que se trataba de reflejar la inercia química del benceno. Recientemente Van Temelen sintetizó el benceno de Dewar "biciclo (2,2,0) hexadieno", sustancia que sufre una rápida isomerización de enlace de valencia para dar benceno.
Un análisis de las características químicas del benceno permite ir descartando estas posibles estructuras. Así, el benceno sólo da un producto monobromado:
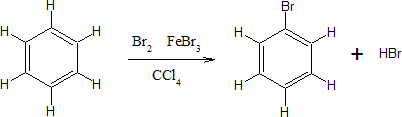
Es decir, se sustituye un hidrógeno por un bromo y se mantienen los tres dobles enlaces. Esto implica que los hidrógenos deben ser equivalentes, ya que el reemplazo de cualquiera de ellos da el mismo producto, por lo tanto podemos descartar las estructuras I, II y V propuestas.
Asimismo el benceno reacciona nuevamente con el halógeno para dar tres derivados disustituidos isómeros de fórmula molecular C6H4X2 ó C6H4XZ. Este comportamiento esta de acuerdo con la estructura III.
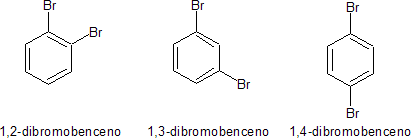
Esta estructura III a su vez permitiría dos isómeros 1,2-dihalogenado, que serían:

pero realmente sólo se conoce uno. Kekulé sugirió incorrectamente que existe un equilibrio rápido que convierte un isómero en el otro, en el caso del derivado dibromado
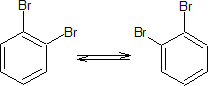
Para poder comprenderlo, hay que tener en cuenta que la estructura de Kekulé de dobles enlaces, los enlaces sencillos serían más largos que los dobles enlaces. Sin embargo, esto no es así, ya que experimentalmente se ha comprobado que los enlaces carbono-carbono en el benceno son todos iguales (1,397 A) y que el anillo es plano. Entonces lo que sucede con las estructuras de Kekulé, las cuales solo difieren en la ubicación de los enlaces p, es que el benceno realmente es un híbrido de resonancia entre estas dos estructuras:
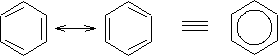
de tal manera que los electrones p están deslocalizados a lo largo de la estructura, y por tanto el orden de enlace carbono-carbono es aproximadamente 1.1/2 . De acuerdo con esto los enlaces carbono-carbono son más cortos que los enlaces sencillos pero más largos que los dobles enlaces.
Por todo ello la estructura real del benceno no es ninguna de las de Kekulé sino la del híbrido de resonancia que se representa con un hexágono con un círculo, lo que sucede es que para una mejor comprensión del comportamiento y para poder explicar algunos mecanismos de reacción, haremos uso de las estructuras de Kekulé.
Este planteamiento de resonancia por deslocalización permite explicar la mayoría de los propiedades del benceno y sus derivados en función de la estructura. De acuerdo con lo dicho, el benceno consiste en un anillo donde los seis átomos de carbono presentan una hibridación sp2, uniéndose a dos átomos de carbono adyacente y a un átomo de hidrógeno. De esta manera los enlaces carbono-carbono son todos iguales y los ángulos de enlace son exactamente de 120º.
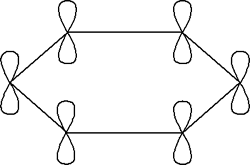
Como consecuencia y tal como se ve en la segunda figura cada átomo de carbono tendría un orbital p sin hibridar que sería perpendicular al plano que forma el anillo de carbonos en donde se alojaría un electrón. Estos seis electrones que según la estructura de Kekulé serían los que darían lugar a los tres dobles enlaces (enlace p) realmente lo que hacen es deslocalizarse a lo largo de todo el anillo, por lo cual se representa el benceno mediante un hexágono con un círculo inscrito, en lugar de los tres dobles enlaces localizados.
Con esto lo que se pretende es recordar que de hecho no hay tres enlaces sencillos ni tres dobles enlaces, ya que como hemos dicho los enlace son iguales, y de esa manera evitar que se puedan representar isómeros supuestamente diferentes y que sólo se diferencien en la colocación de los dobles enlaces, ya que se suele recurrir a las estructuras de Kekulé para representar mecanismos e indicar el desplazamiento de pares de electrones individuales.
Otra característica química del benceno, es que es mucho más estable de lo que se podría esperar a partir de estos esquemas de resonancia por deslocalización. Si partimos de la estructura de Kekulé, ésta presenta tres dobles enlaces que nos presentarían al benceno como un trieno cíclico conjugado, por lo cual cabría esperar que reaccionase de forma similar en las reacciones típicas de los polienos. Sin embargo, sus reacciones son excepcionales, como podemos ver en las siguientes reacciones, donde lo comparamos con un alqueno cíclico:
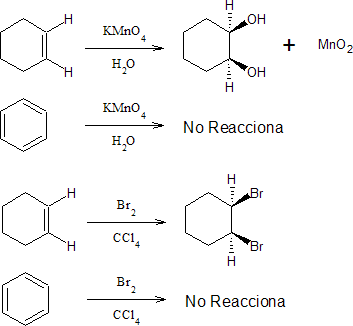
Esta gran estabilidad que presenta el benceno viene confirmado por el hecho de que su calor de hidrogenación es menor que el del 1,3-ciclohexadieno. Si consideramos que la energía de hidrogenación del ciclohexeno es de –28,6 kcal/mol teóricamente la energía del benceno partiendo de la estructura de Kekulé debería ser –75,8 kcal/mol, cuando en realidad es de –49,8 kcal/mol, lo indica que presenta una energía de resonancia de 36 kcal/mol. Todo ello indica que el anillo de benceno es excepcionalmente inerte, ya que para hidrogenarlo se requieren presiones y temperaturas altas.
NOMENCLATURA
Regla 1. En bencenos monosustituidos, se nombra primero el radical y se termina en la palabra benceno.

Regla 2. En bencenos disustituidos se indica la posición de los radicales mediante los prefijos orto- (o-), meta (m-) y para (p-). También pueden emplearse los localizadores 1,2-, 1,3- y 1,4-.
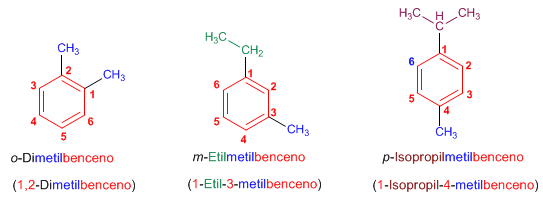
Regla 3. En bencenos con más de dos sustituyentes, se numera el anillo de modo que los sustituyentes tomen los menores localizadores. Si varias numeraciones dan los mismos localizadores se da preferencia al orden alfabético.
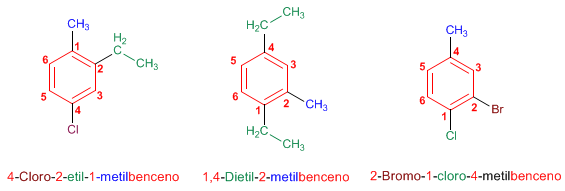
Los bencenos monosustituidos se nombran terminando el nombre del sustituyente en benceno.

Algunos derivados monosustituidos del benceno tienen nombres comunes ampliamente aceptados.

En bencenos disustituidos se emplean los prefijos orto (benceno 1,2-disustituido), meta (benceno 1,3-disustituido) y para (benceno 1,4-disustituido) para indicar la posición de los sustituyentes en el anillo.

DERIVADOS SUSTITUIDOS CON NOMBRE PROPIO
- CATECOL

- RESORCINOL

- HIDROQUINONA

- O-XILENO

- M-XILENO
- P-XILENO

- O- CRESOL
- M-CRESOL

- P-CRESOL
NITRACIÓN DEL BENCENO
El benceno reacciona con la mezcla nitrico-sulfurico adicionando grupos nitro.
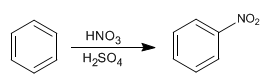
El electrófilo de esta reacción es el catión nitronio. NO2+. Las concentraciones de este catión en el ácido nitrico son muy bajas para nitrar el benceno, por ello es necesario añadir ácido sulfúrico.
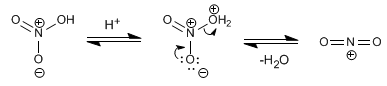
HALOGENACION DEL BENCENO
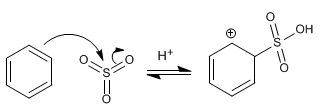
Etapa 2. Recuperación de la aromaticidad por pérdida de un protón.
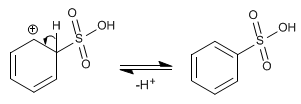
El mecanismo de la sulfonación es reversible, lo cual permite eliminar el grupo -SO3H por tratamiento con sulfúrico acuoso. Esta propiedad es utilizada para proteger posiciones del benceno, ocupándolas con el grupo -SO3H.
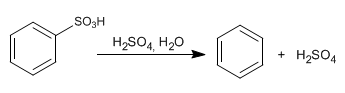


SUSTITUCIÓN EN DERIVADOS










































- Los hidrocarburos aromáticos están representados por el benceno.
- El benceno es un híbrido de resonancia, debida a la estructura electrónica de la molécula.
El benceno reacciona con la mezcla nitrico-sulfurico adicionando grupos nitro.

El electrófilo de esta reacción es el catión nitronio. NO2+. Las concentraciones de este catión en el ácido nitrico son muy bajas para nitrar el benceno, por ello es necesario añadir ácido sulfúrico.

HALOGENACION DEL BENCENO
El benceno reacciona con halógenos en presencia de ácidos de Lewis para formar derivados halogenados.
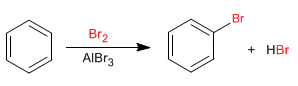
El mecanismo de la halogenación tiene lugar con las siguientes etapas:
Etapa 1. La molécula de bromo se polariza al interaccionar con el ácido de Lewis. El benceno ataca al bromo polarizado positivamente para formar el catión ciclohexadienilo.
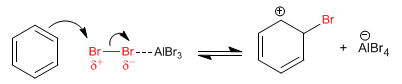
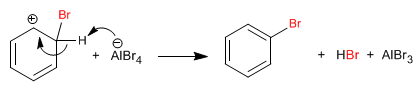
Etapa 2. Recuperación de la aromaticidad por pérdida de un protón.
La cloración se puede llevar a cabo de forma similar a la bromación. La reacción con flúor y yodo se realiza muy poco frecuentemente. En el caso del flúor la reacción es dificil de controlar por su elevada reactividad. Por el contrario, el yodo reacciona lentamente y tiene un equilibrio desfavorable.
Sulfonación.
La sulfonación de anillos aromáticos proporciona ácidos arilsulfónicos. Esta reacción se lleva a cabo empleando ácido sulfúrico fumante, que es el nombre de una disolución al 7% de trióxido de azufre (SO3) en H2SO4. El trióxido de azufre es el anhidrido del ácido sulfúrico, lo que significa que al agregar agua al SO3 se produce H2SO4. El SO3 es un electrófilo fuerte, puesto que los tres enlaces sulfonilo (S=O) atraen la densidad electrónica y la retiran del átomo de azufre. A continuación, se indican las estructuras resonantes del SO3. Aunque la más importante es la estructura de la izquierda, porque no comporta separación de cargas, las otras tres estructuras resonantes, son las que ponen de manifiesto el carácter electrofílico de este átomo porque en ellas el átomo de azufre soporta una carga positiva.
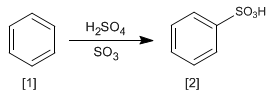
La reaccion del benceno [1] con una disolución de trióxido de azufre en ácido sulfúrico produce ácidos bencenosulfónicos [2].
El mecanismo de la sulfonación tiene lugar con las siguientes etapas:
Etapa 1. Ataque del benceno al trióxido de azufre

El mecanismo de la halogenación tiene lugar con las siguientes etapas:
Etapa 1. La molécula de bromo se polariza al interaccionar con el ácido de Lewis. El benceno ataca al bromo polarizado positivamente para formar el catión ciclohexadienilo.
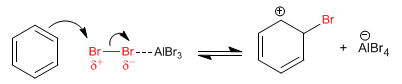
Etapa 2. Recuperación de la aromaticidad por pérdida de un protón.

La cloración se puede llevar a cabo de forma similar a la bromación. La reacción con flúor y yodo se realiza muy poco frecuentemente. En el caso del flúor la reacción es dificil de controlar por su elevada reactividad. Por el contrario, el yodo reacciona lentamente y tiene un equilibrio desfavorable.
Sulfonación.
La sulfonación de anillos aromáticos proporciona ácidos arilsulfónicos. Esta reacción se lleva a cabo empleando ácido sulfúrico fumante, que es el nombre de una disolución al 7% de trióxido de azufre (SO3) en H2SO4. El trióxido de azufre es el anhidrido del ácido sulfúrico, lo que significa que al agregar agua al SO3 se produce H2SO4. El SO3 es un electrófilo fuerte, puesto que los tres enlaces sulfonilo (S=O) atraen la densidad electrónica y la retiran del átomo de azufre. A continuación, se indican las estructuras resonantes del SO3. Aunque la más importante es la estructura de la izquierda, porque no comporta separación de cargas, las otras tres estructuras resonantes, son las que ponen de manifiesto el carácter electrofílico de este átomo porque en ellas el átomo de azufre soporta una carga positiva.
La reaccion del benceno [1] con una disolución de trióxido de azufre en ácido sulfúrico produce ácidos bencenosulfónicos [2].

El mecanismo de la sulfonación tiene lugar con las siguientes etapas:
Etapa 1. Ataque del benceno al trióxido de azufre

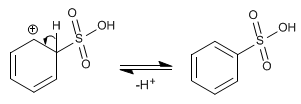
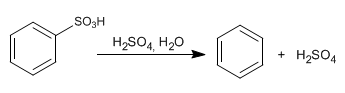
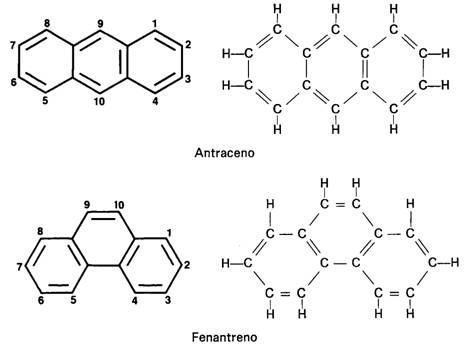
HIDROCARBUROS AROMÁTICOS CONDENSADOS O POLICICLICOS

PROPIEDADES FÍSICAS
- Poseen una gran estabilidad debido a las múltiples formas resonantes que presenta.
- Son insolubles en agua.
- Muy solubles en disolventes no polares como el éter.
- Es un líquido menos denso que el agua.
- Sus puntos de ebullición aumentan, conforme se incrementa su peso molecular.
- Los puntos de fusión no dependen únicamente del peso molecular sino también de la estructura.

SUSTITUCIÓN EN DERIVADOS
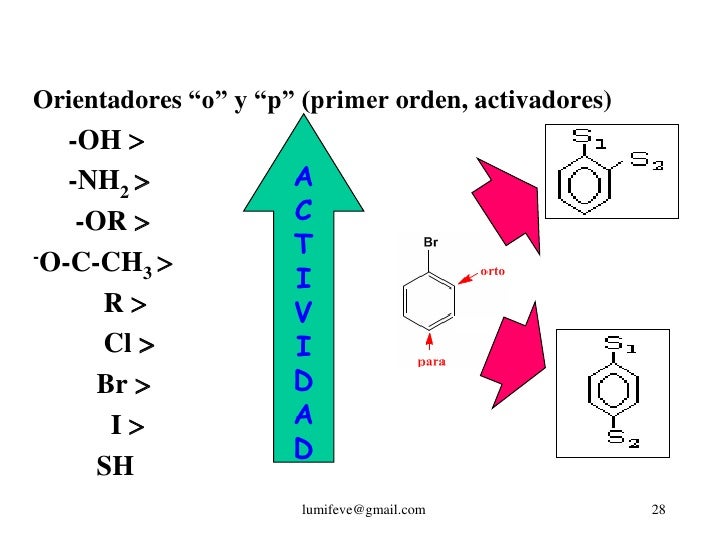
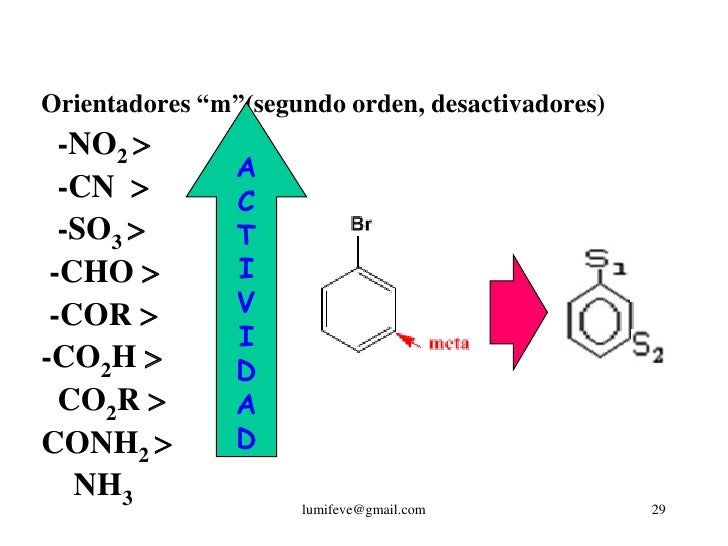
Para la introducción de un segundo sustituyen te surge la pregunta cual de los cinco lugares restantes sera ocupado por el nuevo grupo, para ello utilizamos los orientadores o directores.
ORTO Y PARA
- ANILINA
- FENOL
- ALQUIL
- HALOGENO
META
- ALDEHIDO
-ACIDO
-NITRO


PROCEDIMIENTO
LINK N°1
HIDR. AROMÁTICOS I
CORRECCIÓN LINK N°1
HIDR. AROMÁTICOS II
CORRECCIÓN HIDR. AROMÁTICOS II
LINK N°2
CORRECCIÓN
LINK N°3
CORRECCIÓN
LINK N°4
CORRECCIÓN
CONCLUSIÓN
- Los hidrocarburos aromáticos están representados por el benceno.
- Fue descubierto en 1825 por Faraday de formula molecular o mínima C6 H6 posteriormente en 1865 Kekulé logra determinar su estructura molecular la cual sustenta la particularidad de sus propiedades y de todos los hidrocarburos aromáticos que tienen una gran importancia industrial.
- Todos los derivados del benceno, siempre que se mantenga intacto el anillo, se consideran aromáticos.
WEBGRAFIA
https://www.textoscientificos.com/quimica/benceno/estructura
https://www.quimicaorganica.org/benceno/278-sulfonacion-del-benceno.html
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Hidrocarburos_arom%C3%A1ticos
http://www.insht.es/InshtWeb/Contenidos/Documentacion/TextosOnline/EnciclopediaOIT/tomo4/104_07.pdf
WEBGRAFIA
https://www.textoscientificos.com/quimica/benceno/estructura
https://www.quimicaorganica.org/benceno/278-sulfonacion-del-benceno.html
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Hidrocarburos_arom%C3%A1ticos
http://www.insht.es/InshtWeb/Contenidos/Documentacion/TextosOnline/EnciclopediaOIT/tomo4/104_07.pdf
EXCELENTE TRABAJO 5,0
ResponderEliminar